
CARACTERISTIQUES
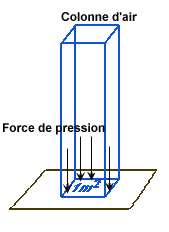
Représentation de la pression exercée par un fluide ou un liquide
En altitude ou en profondeur, différents paramètres varient par rapport au niveau de la mer.
Tout d’abord, l’altitude est une « élévation verticale par rapport au niveau de la mer ». A contrario, la profondeur est définie comme la distance, à un moment et à un endroit donné, qui sépare le fond de la surface de l'eau.
Il existe plusieurs facteurs qui varient en fonction des milieux : la pression est le facteur principal.
La pression est une force exercée par un fluide ou un liquide sur une surface. Donc, P = F/S, avec la pression P en pascal (Pa) , la force F en Newton (N) et la surface S en mètre carré (m²).
La pression est proportionnelle à la force qui agit sur la surface.
Plus la force qui agit sur une surface est grande, plus la pression qui en résulte est élevée. Cette grandeur est mesurée le plus souvent à l’aide d’un baromètre. Le Pascal est l’unité du Système international d'unités. Cependant, en plongée, c’est le bar qui est couramment utilisé : 1 bar = 100 000 Pa. Plus communément on admet qu'un bar vaut 1 kg par centimètre carré.
En altitude la force est uniquement exercée par l’air tandis qu’en profondeur l’eau intervient également.


Baromètre

La Terre est entourée d’une couche d’air, appelée atmosphère. L’air est composé d’une multitude de molécules, 78 % d’azote, 21 % de dioxygène et 1 % d’autres gaz.
La pression atmosphérique (PA) correspond à la force qu’exercent ces molécules sur une surface. Plus on s’élève, moins la quantité de matière exerçant une pression est importante.
La pression atmosphérique est moins importante en altitude qu’au niveau de la mer.
On parle d'hypobarie.
En effet, la pression atmosphérique est d’environ 760 millimètres de mercure (mmHg) au niveau de la mer alors qu’elle est seulement de 250 mmHg au sommet de l’Everest. La pression atmosphérique a longtemps été mesurée en millimètre de mercure (mmHg). Ceci était dû à l'utilisation courante de baromètres à colonne de mercure.
Depuis l'adoption du pascal comme unité de pression, les météorologues utilisent un multiple de cette unité, l’hectopascal (1 hPa = 100 Pa). La pression atmosphérique au niveau de la mer est aussi égale à 1013 hPa et 1,013 bar.
Nous ne la ressentons pas car notre corps est incompressible et ses cavités (estomac, poumons, sinus...) contiennent de l'air à la même pression.
La pression atmosphérique


La composition de l'air en pourcentages
Colonne de mercure

La pression absolue
Plus on est loin de la surface de la mer, plus la pression est importante puisqu’il faut tenir compte du poids de l'eau au-dessus de nous.
La force exercée par l’eau sur un plongeur immergé est appelée pression hydrostatique. Cette force résulte du poids de la colonne d’eau qu’il a au dessus de lui. La pression hydrostatique est aussi appelée pression relative.
A 10 mètres de profondeur, chaque cm² de notre corps supporte le poids d'1 litre d'eau. Sachant qu'1 litre d'eau pèse environ 1 kilogramme, la pression due à l'eau à 10 mètres de profondeur est donc de 1 kg/cm2, soit 1 bar.
De même, si le corps est immergé à 20 mètres, il subit une pression hydrostatique de 2 bars. Ainsi, la pression relative augmente d’1 bar tous les 10 mètres de profondeur.
Tous les liquides transmettent intégralement les pressions. C’est pourquoi tout plongeur subit en plus de la pression hydrostatique, la pression atmosphérique (même si ce corps n’est pas en contact direct avec l'air).
La somme de ces deux pressions est appelée pression absolue, ou pression totale.
Pression Absolue = Pression atmosphérique + Pression Hydrostatique
Par exemple, à 20 mètres de profondeur, la pression absolue est de 3 bars, 1 bar de pression atmosphérique + 2 bars dus au poids de 20m d’eau.
Ce tableau récapitule les différentes pressions en fonction de la profondeur. On remarque que la plus grande variation de pression absolue a lieu près de la surface. En effet, entre la surface et une profondeur de 10 mètres, la pression est multipliée par deux.


Relation existant entre les différentes pressions
Tableau récapitulatif des différentes pressions en fonction de la profondeur

Pression hydrostatique en fonction de la profondeur

La pression partielle
En altitude comme en profondeur, la loi de Dalton joue un rôle important sur la pression des gaz.
Comme nous l’avons dit précédemment, l’air est composé d’environ 80 % d’azote ainsi que de 20 % de dioxygène, et la pression atmosphérique est d’1 bar.
La part de pression due à l'azote est proportionnelle à sa concentration dans l'air : il participe donc pour 80% à la pression atmosphérique.
La "pression partielle" de l'azote dans l'air est de 0,8 bar.
D’après la loi de Dalton, la pression absolue, ou globale (selon le milieu) d’un mélange gazeux est la somme des pressions partielles des gaz qui composent ce mélange.
Pression Absolue/globale = Pression Partielle (gaz1) + Pression Partielle (gaz2)
A une profondeur de 20 mètres, la pression absolue est de 3 bars, la pression partielle de dioxygène sera de 0,6 bar ( 3 x 20% = 0,6). On note les pressions partielles du dioxygène et de l'azote PpO2 et PpN2.
De plus , la pression partielle d'un gaz dans un mélange est égale au pourcentage de ce gaz dans le mélange multiplié par la pression absolue ou globale.
Pression partielle/globale = pression absolue x pourcentage Gaz

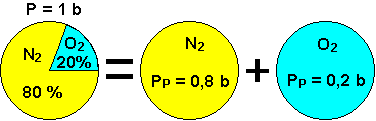
Relation existant entre les différentes pression partielles d'un gaz
Relation existant entre la pression totale d'un gaz et les fractions des gaz présents dans le mélange
b = bar

L'espacement des molécules
En altitude, la pression agit sur l’espacement des molécules. En effet, quand elle augmente, les molécules se rapprochent les unes des autres (compression) alors que quand elle diminue, les molécules s’éloignent les unes des autres (détente).
C’est ce que nous avons démontré dans deux expériences.
Pour les réaliser nous avons eu besoin :
-
D'une grande seringue en plastique
-
D'eau
-
D'un bécher
-
D'une cloche à vide
Protocole : Lors de la première expérience, nous avons aspiré de l'eau dans une seringue, nous avons bouché l'ouverture avec le doigt puis tiré le piston. Puis, pour la deuxième, nous avons rempli le bécher d'eau, et nous l'avons placé sous une cloche. Nous avons ensuite fait diminué lentement la pression.
Résultat et observations : Des bulles se sont formées, l'eau s'est vaporisée dans les deux cas.
L’eau passe de l’état solide à l’état gazeux, les molécules s’éloignent donc.
En altitude, la pression atmosphérique est inférieure à celle du niveau de la mer ce qui signifie donc que les molécules qui composent l’air en altitude sont plus écartées les unes des autres.
Les molécules de dioxygène sont ainsi plus espacées en altitude. A chaque inspiration, la quantité de dioxygène absorbée est plus faible.

Représentation de l'espacement des molécules en fonction de la pression

Le volume de l'air

Bien que l’air soit un mélange de gaz, il peut être considéré comme un gaz parfait.
Il existe alors une relation pour les gaz parfaits :
P.V = n.R.T
avec la pression P du gaz en pascal (Pa), V le volume occupé par le gaz en mètre cube (m³), n la quantité de matière de gaz en moles (mol), R la constante des gaz parfaits et T la température en kelvins (K).
On peut appliquer cette formule pour trouver le volume du gaz lorsque la pression diminue, on obtient:
V = (n.R.T.) / P
Étant donné que la pression diminue en altitude, la valeur du dénominateur diminue également. La valeur du volume augmente donc. On peut en conclure que le volume de l’air est plus important en altitude qu’au niveau de la mer. Au contraire, puisque la pression augmente en profondeur, la valeur du dénominateur augmente.
Le volume de l’air est donc plus faible en profondeur qu’au niveau de la mer.
La loi de Boyle-Mariotte est une conséquence de la loi des gaz parfaits.
En effet, d'après celle-ci : A température constante, le volume d'un gaz varie de manière inversement proportionnelle à la pression absolue à laquelle il est soumis, donc :
P = 1/V
donc P = k/V
donc PV= k
La loi de Boyle-Mariotte est fréquemment utilisée pour comparer deux situations.
Plus la pression augmente, plus le volume diminue et inversement.
Nous avons réalisé une expérience afin de mieux comprendre le phénomène.
Nous avons voulu prouver que suivant la pression, le volume des gaz dans les cavités internes varie.
Pour cela nous avons eu besoin de :
-
1 seringue de 10 mL
-
1 support
-
1 pince à éprouvette
-
1 corde
-
Des masses de 0,5 Kg à 3kg
-
Du dioxygène
Protocole : Nous avons rempli la seringue de 10 mL de dioxygène, puis nous l'avons fixée sur le support grâce à une pince à éprouvette. Ensuite, nous avons attaché une corde aux deux côtés de la seringue. Nous avons donc reproduit le montage ci-contre.
Nous avons suspendu une masse de 0.5Kg puis noté le volume du gaz dans la seringue. Nous avons donc recommencé avec de plus grandes masses. (1kg, 1,5kg, 2kg, 2,5kg, 3kg)
Résultat attendu : Plus la pression sera forte, moins le volume de gaz sera important.
Résultats & Observations :
Plus nous augmentions le poids des masses, plus le volume dans la seringue diminuait. Cependant à partir de 2kg le volume a stagné. Notre montage n'étant pas très précis, la pression exercée n'était plus assez forte pour que le volume diminue d'avantage.
Nos résultats se rapprochent donc de la courbe théorique. Toutefois, nos mesures n'étant pas très précises, il existe un différentiel entre les résultats pratiques et théoriques.
P : pression
V :volume
k : constante de proportionnalité

Comparaison du volume de deux gaz
Montage réalisé lors de notre expérience


Étant donné que la pression globale diminue avec l’altitude et que le pourcentage de dioxygène (environ 20%) reste inchangé, la pression partielle de dioxygène diminue donc avec l’altitude. La proportion de dioxygène en altitude est égale à la proportion de dioxygène au niveau de la mer mais dans un volume plus grand.